癌細胞が被爆したら? 福島の小児甲状腺癌多発 [被曝影響、特に甲状腺]
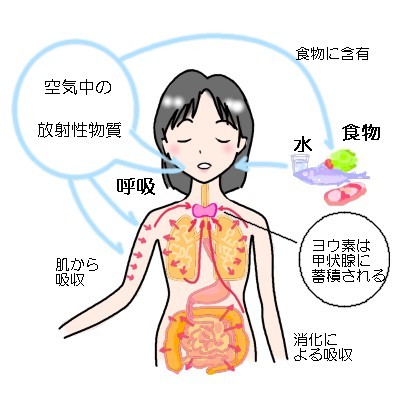
東電核災害の発災当初は放射能雲・ブルームからの放射線と放射性ヨウ素などの吸入による内部被爆でかなりの線量を被曝しています。
放射性ヨウ素は、呼吸により気管支及び肺から、また口から食道を経て消化管から吸収され、体内に入ります。血液にのった放射性ヨウ素は全身をめぐり、隈なく隅から隅まで内部被曝させます。とり込まれた放射性ヨウ素の約10~30%は、24時間以内に喉にある甲状腺に選択的特異的に集積し高い線量の被曝をもたらします。集積しなかった物の20%位は直ちに残りは徐々に尿中に排泄されます。
この吸収されたヨウ素の半量が人体から排泄される日数、生物学的半減期は・乳児 11日・5歳児 23日・成人 80日です。その間に物理的に核崩壊して放射性ヨウ素131はベータ線とガンマ線を放出して、キセノン-131(131Xe)となる物もあります。このキセノン-131は放射線線を出さない安定した希ガスで呼吸で排出されます。
甲状腺に集積した放射性ヨウ素は、蛋白質と結合して貯蔵されます。そして甲状腺ホルモンの原料として使われ甲状腺から出て最終的には尿排泄されるか、物理的半減期8日に従って崩壊してベータ線とガンマ線を放出して、キセノン-131(131Xe)になります。前者の代謝での甲状腺での半減期は13~140日(新陳代謝の活発さでちがう)。この代謝で排出されるまで甲状腺内に蓄積された放射性ヨウ素は放射線を出し続けます。その間中、甲状腺は被曝しつづけます。
実効半減期
放射性物質の半減期と生物学的半減期の双方の効果から、体内に一度に取り入れられた(追加の定常的な摂取が無いとした場合)放射性物質の残留量が半分になる期間を実効半減期といいます。日本人では、乳児で約5日、5歳児で6日、成人で8日と試算されています。
この放射性ヨウ素のように、放射線を出して崩壊する物理的半減期に比べ、体から出て行く生物学的半減期が長いと、一旦入った放射能は中々出て行かず、体内に留まる間の被曝・内部被曝が高くなります。それでまず核事故発災時に予め放射線を出さない安定ヨウ素で甲状腺や血液を満たしておいて、事故で放出される放射性ヨウ素の甲状腺摂取・蓄積量をへらすことが、被爆量全体を減らす上でとても有効になります。
また、体内・甲状腺から代謝・崩壊で減っていく分より多くの放射性ヨウ素を水や食品などで摂取し甲状腺にとりこむと、結果的に蓄積します。このように継続的に摂取した場合は、先ほどの実効半減期を越えて高い内部被爆状態が続くことになります。東電核災害では、汚染されていない飲食物が十分に届かなかったのですから、中々減らなかった人も多数いると思います。日本人では、乳児で約5日、5歳児で6日、成人で8日と試算されている実効半減期が当てはまらない人が多数いると思います。
癌細胞が低線量の被爆をしたら
このように東電核災害で甲状腺は他の臓器、全身に比して高い線量を被曝しました。この被曝で、甲状腺に既にあった癌細胞・癌塊はどのような影響を受けたのでしょうか?
甲状腺癌の治療法に放射性ヨウ素131を服用し放射線で焼殺す方法が50年以上前からあります。原則として、甲状腺を外科的に全摘して、転移が認められたり、腫瘍組織の残存があった場合などおこなわれています。これでは一般的投与量は3.7~7.4億ベクレル。これによって甲状腺に照射される放射線量は数十シーベルト。それで、甲状腺癌を殺すわけですが、その線量に較べれば遥かかに小さいですが、甲状腺に既にあった癌細胞・癌塊はどのような影響を受けたのでしょうか?
一般的には、細胞分裂の際の遺伝子や染色体の複製の間違え、様々な化学物質の影響、カリウム40などの天然放射能の出す放射線や宇宙から飛来する放射線の被曝などでDNAが損傷し、それで遺伝子が変異すると、癌細胞が生まれるとされます。その癌細胞も癌病が進展すると、転移できる癌細胞が現れたり倍加が速くなる変異を顕します。
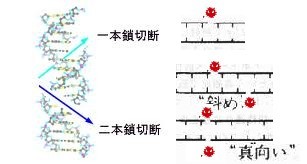
吸収線量2.5mSv(2.5mGy)を人の細胞(初代培養繊維芽細胞)に照射すると、15個の細胞当り1個のDNAの2重鎖切断(DSB)が起きるそうです。5mSvなら2個(細胞7.5個に1個)、7.5mSvなら3個(細胞5個に1個)、10mSvなら4個(細胞3.75個に1個)と照射線量に応じてDNAの2重鎖切断(DSB)が起きるそうです。
このような少数のDNA損傷は、損傷応答機構では感知され難くほとんど修復されずに残ります。それの修復は、次回の細胞分裂の際に行われます。その時には、①修復に成功②修復失敗しアポトーシス(細胞自死)や増殖を停止した老化細胞になる③修復失敗して次世代の細胞に持ち越され、損傷が蓄積④修復失敗して染色体が不安定化するといった経過をたどります。
①、②では問題は起きません。③でDNA損傷が遺伝情報を担う部分(ヒトのDNA全体の約1割)なら、何らかの遺伝子損傷になります。甲状腺の細胞で、目の細胞で働く遺伝子が損傷しても無問題ですが、甲状腺で働く遺伝子なら甲状腺機能を損います。その遺伝子が癌原遺伝子(細胞増殖のアクセル役)や癌抑制遺伝子(細胞増殖のブレーキ役)で、それが蓄積されたりして複数個損傷・異常になると癌細胞化するという多段発ガン説が最も有力な学説です。
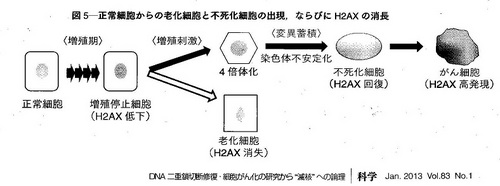
④の修復に失敗して染色体分離が不完全になり、細胞2個分の染色体・ゲノムをもった細胞、4倍体細胞が生まれます。この4倍体細胞は染色体が不安定化したゲノム不安定性(染色体不安定性)を呈し、変位が蓄積して不死化細胞となります。さらに変異を重ね無限増殖などを持つ癌細胞化します。この不死化細胞と癌細胞は、H2AXという蛋白質の量で明瞭に区別されるそうです。これを染色体不安定説です。癌細胞では、染色体は不安定で変異が起こり易いのです。
ですから癌細胞の特徴で倍加に関わる寿命死がなく、栄養さえあれば死ぬことはない不死性と細胞周期の長期化、誘導されるアポトーシスを回避する性質は関連はしているが別々の仕組み、正常細胞の仕組みの損傷を現しています。
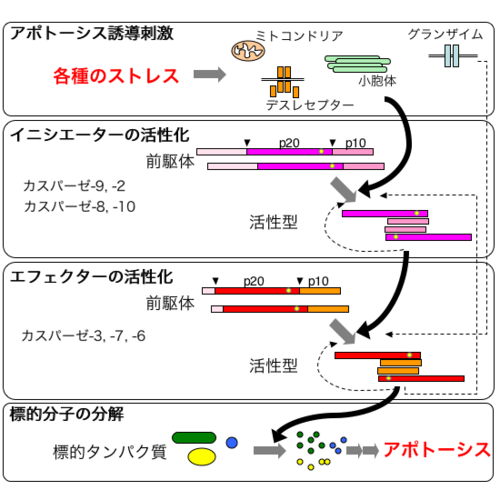
細胞外部から免疫系などの誘導で癌細胞でもアポトーシスが起こっていることから、正常細胞に有るアポトーシスの仕組みは、残っている。活性化された酵素が細胞内の細胞が形を保ち生存していくために重要な役割を持つ蛋白質を切断する仕組み自体は癌細胞でも残っています。
癌細胞は、さらにNK細胞などの免疫系で誘導されてスイッチ入りが難くなって誘導・強制アポトーシスを回避するようになった細胞。
誘導・強制アポトーシスはウイルスに感染した細胞に対してもあります。その起こり方は次のようです。
誘導アポトーシス(細胞自死)
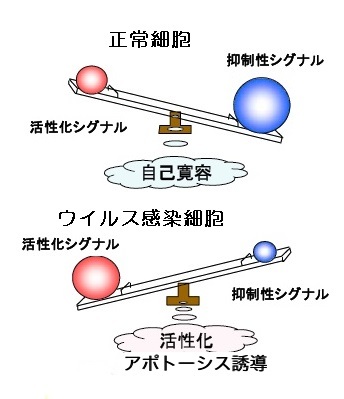
ナチュラルキラーNK細胞は表面に2種類の受容体・レセプターを持っています。一つは、活性化レセプター。ウイルス抗原(ウイルスのつくる蛋白質の小片)などを受容・認識してNK細胞の細胞傷害活性を活性化するシグナルをNK細胞に出します。そして受けたNK細胞はアポトーシス誘導分子を細胞表面に発現したり、タンパク質分解酵素を放出したりなどして、標的のウイルス感染細胞のアポトーシスを誘導します。
もう一つは、抑制性レセプター。細胞表面にある蛋白質・MHCクラスⅠのα鎖という部分を受容認識して、細胞傷害活性を沈静化するシグナルをNK細胞に出します。活性化レセプターの活性化シグナルが、抑制性レセプターからの抑制性シグナルより優位になるとNK細胞は標的細胞にアポトーシスを誘導します。
NK細胞は抹消血のリンパ球の10%~30%あり、成人では約50億個あるそうです(内1割程度、1から5億個程度が血液にあり体内を回っている)。体重1kg・約1兆個の細胞に約1億個ですから1万分の1の割合です。極めて少ないのでウイルスに感染した細胞は、NK細胞を活性化し呼び寄せる情報伝達物質(インターフェロンα/β)を出します。普段の正常細胞は、この情報伝達物質を微量産出しています。いわば車のアイドリング状態です。感染すると、アクセルを踏み込んで産出・放出量を増やします。 (続く)
2013-12-09 15:34
nice!(0)
コメント(0)
トラックバック(0)




コメント 0